Page 6 - มวลสารสัมพันธ์
P. 6
ห น้ า | 34 บทที่ 2 มวลสารสัมพันธ์ในปฏิกิริยาเคมีว่าด้วยอะตอม นิวเคลียส โมเลกุล และไอออน
3. ไอโซโทป
ไอโซโทป (isotope) คืออะตอมของธาตุที่มีเลขอะตอม (Z) เท่ากัน แต่มีเลขมวล (A) ต่างกัน เช่น ซิลิกอนที่
พบในธรรมชาติมี 3 ไอโซโทป ดังนี้
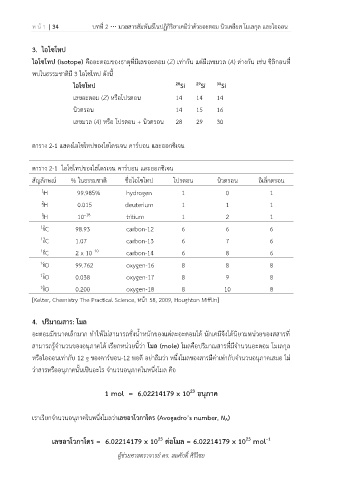
ไอโซโทป 28 Si 29 Si 30 Si
เลขอะตอม (Z) หรือโปรตอน 14 14 14
นิวตรอน 14 15 16
เลขมวล (A) หรือ โปรตอน + นิวตรอน 28 29 30
ตาราง 2-1 แสดงไอโซโทปของไฮโดรเจน คาร์บอน และออกซิเจน
ตาราง 2-1 ไอโซโทปของไฮโดรเจน คาร์บอน และออกซิเจน
สัญลักษณ์ % ในธรรมชาติ ชื่อไอโซโทป โปรตอน นิวตรอน อิเล็กตรอน
1 1 H 99.985% hydrogen 1 0 1
2 1 H 0.015 deuterium 1 1 1
–18
3 1 H 10 tritium 1 2 1
12 98.93 carbon-12 6 6 6
C 6
13 6 C 1.07 carbon-13 6 7 6
–10
14 6 C 2 x 10 carbon-14 6 8 6
16 8 O 99.762 oxygen-16 8 8 8
17 8 O 0.038 oxygen-17 8 9 8
18
8 O 0.200 oxygen-18 8 10 8
[Kelter, Chemistry The Practical Science, หน้า 58, 2009, Houghton Mifflin]
4. ปริมาณสาร: โมล
อะตอมมีขนาดเล็กมาก ท าให้ไม่สามารถชั่งน้ าหนักของแต่ละอะตอมได้ นักเคมีจึงได้นิยามหน่วยของสสารที่
สามารถรู้จ านวนของอนุภาคได้ เรียกหน่วยนี้ว่า โมล (mole) โมลคือปริมาณสารที่มีจ านวนอะตอม โมเลกุล
หรือไอออนเท่ากับ 12 g ของคาร์บอน-12 พอดี อย่าลืมว่า หนึ่งโมลของสารมีค่าเท่ากับจ านวนอนุภาคเสมอ ไม่
ว่าสารหรืออนุภาคนั้นเป็นอะไร จ านวนอนุภาคในหนึ่งโมล คือ
23
1 mol = 6.02214179 x 10 อนุภาค
เราเรียกจ านวนอนุภาคในหนึ่งโมลว่าเลขอาโวกาโดร (Avogadro’s number, NA)
23
–1
เลขอาโวกาโดร = 6.02214179 x 10 ต่อโมล = 6.02214179 x 10 mol
23
ผู้ช่วยศาสตราจารย์ ดร. สมศักดิ์ ศิริไชย